突破300bp限制,快速构建并筛选海量变异文库
转发于 2025年03月11日 17:32

在《科学家》播客栏目《Lab Talk》最近一期节目中,哈佛医学院博士后研究员Josh Tycko的热情极具感染力。他谈到了DNA合成技术的最新进展为功能基因组学研究带来的不断演变。
“这是科学创造力迸发的黄金时代"。新技术为研究者提供了前所未有的DNA"构建空间",助力筛选实验设计并揭示未知序列的功能。
技术突破驱动分子生物学革命,分子生物学的进步往往源于底层技术的跃迁。正如二代测序(NGS)曾以惊人的速度和通量完成基因测序与解读。
当技术简化了复杂的流程
创造力便能蓬勃发展
当前,分子生物学正迎来与二代测序(NGS)、人工智能(AI)及DNA合成技术深度融合的新纪元。Twist推出的多基因片段库(Multiplexed Gene Fragments)首次突破300 bp的传统合成极限,实现500 bp长片段的高通量合成。这一突破使研究者如Tycko得以摆脱一些技术桎梏,来探索功能基因组学与de novo蛋白质工程。
“你可以专注于设计心仪的蛋白质家族,以及如何设计一个新的报告系统”,Tycko描述道,“借助这些合成文库,单人单次实验即可系统解析整个蛋白家族的功能图谱。”
什么是多基因片段库(MGF)?
Twist 多基因片段库(MGF)是通过大规模并行固相DNA合成技术直接合成的双链基因片段池,长度介于301-500 bp,可包含数十万条独特DNA序列。这种混合形式的基因库使研究者能快速生成候选DNA序列或遗传变异库用于高通量筛选。
事实证明,由于长度优势和混合合成特性,多基因片段库(MGFs)具有革命性意义。传统基因片段采取逐个合成的生产方式,这种方式在小规模项目中表现良好,但规模化后会变得成本高昂且流程复杂,例如Tycko所使用的大规模并行报告基因分析等技术。
因此,研究人员无法通过单次筛查研究所有遗传变异,这既拖慢了研究进度又限制了科学发现。此外,标准DNA合成最大长度仅300 bp,研究人员必须通过复杂费力的拼接流程将多个DNA片段组合,才能获得所需序列。
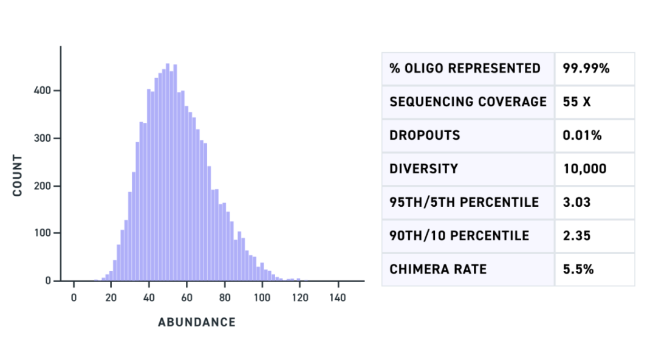
图1. 扩增后的500 bp多基因片段库中,已定位双gRNA变体的测序读数分布图(X轴表示不同变体)。
多基因片段库(MGF)通过提供定制的双链 DNA 片段库来应对这些挑战,这些片段长度可达 500 bp,而且几乎可以达到任何规模。Twist 公司通过以混合形式合成更长的基因片段,使Tycko能够开展以前难以想象的高通量筛选实验。
“当得知可以运用多基因片段库(MGF)时,对我们的研究而言这无疑是振奋人心的消息”, 他说道,“我们知道,现在正是开展这个高通量招募项目的合适时机。”
高通量功能基因组学
对研究效应蛋白结构域活性的Tycko及其同事而言,招募实验(Recruitment Assay)的低通量特性长期制约研究进程。招募实验是合成生物学领域的经典方法。Tycko解释道:该方法通过将DNA结合结构域与转录效应器进行工程化融合,当靶标被招募后即可调控基因表达。
尽管传统方法具有重要价值,但其低通量特性导致每次仅能构建少量新型融合蛋白。Tycko及其同事团队通过整合新一代测序技术、自动化细胞分选与多基因片段库(MGF),将这一传统方法升级为HT-Recruit高通量筛选技术。
据Tycko介绍,HT-Recruit的工作在原理上与传统方法相同,但在规模上实现指数级突破。“我们让每个细胞仅表达一种候选效应结构域,通过单次培养数亿规模的细胞群体,筛选能力从数百跃升至百万量级。”
“实现HT-Recruit的关键在于长片段DNA文库技术的突破”,Tycko强调。更长基因片段可编码更复杂的蛋白结构域。由于30%已知效应结构域长达100个氨基酸(对应300bp以上DNA序列),传统300bp的合成限制曾将这类重要研究对象拒之门外。
在真实生物系统中,蛋白结构域通过复杂互作调控基因表达。但受限于基因片段长度,组合型效应结构域研究长期停滞。
“在多基因片段库(MGF)问世前,我们不得不分步克隆单个结构域,再通过连接肽进行人工拼接构建组合文库等等,整个过程异常繁琐”,Tycko回忆道。
如今借助多基因片段库(MGF),HT-Recruit可实现效应结构域的大规模并行组合测试。“只需在计算机上输入目标结构域组合,就能一次性获得完整DNA文库,这让整个过程轻松容易。”
探寻意外新发现
多基因片段库赋予研究人员更广阔的序列探索空间,使大规模验证创新假说成为可能。Tycko指出:合成文库带来的科学问题近乎无限。不仅能验证既定假说,更可邂逅意料之外的发现。
“打开一扇发现未知的大门
意外之喜触手可及”
2020年,其团队运用HT-Recruit系统对已知KRAB蛋白结构域进行全景式扫描,意外发现部分本应发挥抑制作用的结构域竟呈现强激活特性1。
这一颠覆性发现不仅揭示了效应结构域的进化奥秘,更催生出新型高效CRISPRa复合体2。“若没有多基因片段库,我们绝不能踏上这条惊喜之旅”。
基因组学研究的缩影
Tycko团队的研究成果凸显了多基因片段库(MGF),可以成为功能基因组学领域的一种变革性的工具。研究人员不再受限于传统技术桎梏,能够快速构建并筛选海量变异文库,让每个潜在变异都获得公平的验证机会。
这项突破性技术解放了科研人员的创造力,使快速获取答案与邂逅意外发现成为新常态。正如Tycko所总结:“它为你打开了一扇发现未知世界的大门。”
参考文献:
1.Tycko, Josh, et al. “High-Throughput Discovery and Characterization of Human Transcriptional Effectors.” Cell, vol. 183, no. 7, Dec. 2020, pp. 2020-2035.e16, https://doi.org/10.1016/j.cell.2020.11.024.
2.Tycko, Josh, et al. “Development of Compact Transcriptional Effectors Using High-Throughput Measurements in Diverse Contexts.” Nature Biotechnology, 1 Nov. 2024, https://doi.org/10.1038/s41587-024-02442-6.
推荐文章
-
低起始量样本的靶向甲基化测序通常存在相当大的挑战,因为未甲基化胞嘧啶的转化降低了基因组测序的复杂度。Twist 的甲基化检测系统通过组合探针的能力(可以实现不同级别的优化过滤严谨度)有效地克服了这些障碍,同时还引入了甲基化促进剂,这是一种定制的阻断剂,通过减少脱靶来产生协同作用,以提高系统性能。这两种优化都极大地提高了甲基化检测组合观测到的测序性能,促进了 Twist 甲基化检测系统可支持液体活检等高灵敏度应用的改进。...
-
专家视角|Julian Jude谈功能基因组学的新时代 市场部 Twist Bioscience 拓唯思特 2025年02月18日 17:30 北京 当下正是功能基因组学研究的黄金时代。CRISPR技术工具库的持续扩展,使研究者能以更复杂、更大规模的方式操控基因组;人工智能(AI)助力多模态数据分析,不仅能优化功能筛选设计,还能从中挖掘更深层的生物学意义。如今,功能基因组学研究已迈入规模化与高效化并行的新纪元。这些划时代的进步,离不开合成DNA制备技术的同步革新——这一常被忽视的技术,实为现代分子生物学的基石。 近期,我们与Julian Jude博士 深入探讨了过去十年合成DNA技术的演进,以及它如何推动当今功能基因组学的蓬勃发展。 专家简介 Julian是功能基因组学领域的资深专家,拥有20余篇学术论文及多项专利申请。在攻读博士及博士后期间,他开发了用于靶点识别的新型功能基因组学工具,主导了70余项全基因组shRNA与CRISPR筛选项目,并参与创建了CRISPR单导RNA(sgRNA)设计评分...
-
古代 DNA 的前景在于其信息承载能力。存储在 DNA 中的模式可以告诉我们古代原始人的生活、他们那个时代的人口动态,以及现代人类是如何形成的。但是,从这些风化样本中提取这些信息并非易事。这不仅在技术上具有挑战性,而且提取 DNA 的过程是破坏性的,这意味着这些珍贵的文物即使不是彻底销毁,也必须被破坏。因此,在处理古代 DNA 时,对错误的容忍度很小——即使是很小的低效率也会造成无法弥补的损失。由于风险如此之高,研究人员能够获得最适合这项工作的工具至关重要。...